美国加州大学伯克利分校化学工程系教授、劳伦斯国家实验室合成生物学中心主任Jay Keasling 是合成生物学研究领域的领军人物(图1),他的杰出工作是将来源于不同生物的基因进行设计、组装,最后在酵母工程菌中建立了一条非天然的代谢途径大量合成抗疟疾药青蒿素前体—青蒿酸(自然界非常稀少的物质)。
 疟疾每年大约会感染5亿世界上最贫困的人,并且致使其中多达100万人丧生,丧生者多数是5岁以下的儿童。青蒿素与其它药物的联合使用,是目前唯一一种始终有效的治疗方法。天然的青蒿素是在草药青蒿(Artemisia annua)中提取(图2),但是产量十分稀少,提取工艺复杂,提取成本极其昂贵,供应量无法满足世界各地患者的需要。
疟疾每年大约会感染5亿世界上最贫困的人,并且致使其中多达100万人丧生,丧生者多数是5岁以下的儿童。青蒿素与其它药物的联合使用,是目前唯一一种始终有效的治疗方法。天然的青蒿素是在草药青蒿(Artemisia annua)中提取(图2),但是产量十分稀少,提取工艺复杂,提取成本极其昂贵,供应量无法满足世界各地患者的需要。
Keasling意识到如果合理利用合成生物学的工具,就可以完全不受自然条件控制,将每一个细胞都变成合成青蒿素的小工厂,生产出制作药物所需的化学物质,那么就不再需要繁复且成本很高的生产过程了。为什么不试着由基因片段出发,构造一个细胞去生产青蒿酸呢?Keasling和他的研究小组将来源于高等青蒿的青蒿素合成酶(ADS)和新型细胞色素P450单加氧酶基因(CYP71AV1)植入酵母,酵母会把代谢中产生的中间化合物改造成青蒿酸(图3)。他们利用酵母天然的甲羟戊酸途径,该途径在正常情况下通过糖类代谢产生乙酰辅酶A来合成甾醇;而在他们所合成的代谢途径中,甲羟戊酸途径被用来大量产生中间体法尼焦磷酸盐(FPP),而法尼焦磷酸盐接下来可被在酵母中表达的ADS 和CYP71AV1催化产生青蒿酸。这一工作的难度在于对来自酵母、青蒿多种基因及其代谢途径的组装与精密调控。Keasling教授的这一研究成果也于2006年在世界权威杂志《NATURE》上发表。微生物工业生产青蒿素的技术链条已基本成形,为尽快使研究成果产业化,Keasling 协助建立了Amyris生物技术公司, 用合成生物学技术进行抗疟疾药及生物能源的生产。
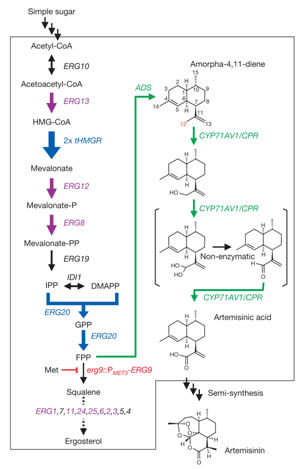
图3. 酵母中合成青蒿酸的流程图
借助合成生物学手段在简单生物比如大肠杆菌和酵母中,设计代谢途径和模块组成的生物级联来改变正常的细胞代谢,从而产生一些非天然、人们感兴趣的代谢物。这些代谢物可能是目标物质,也可能是中间体。这正如Keasling所说:“利用合成生物学的工具,我们将不必仅仅被动的接受自然给我们提供的东西”。
|